Vorhofseptumdefekt
Begutachtet von Dr. Hayley Willacy, FRCGP Zuletzt aktualisiert von Dr. Colin Tidy, MRCGPZuletzt aktualisiert am 21 April 2023
Erfüllt die Anforderungen des Patienten redaktionelle Richtlinien
- HerunterladenHerunterladen
- Teilen Sie
- Sprache
- Diskussion
Medizinisches Fachpersonal
Professionelle Referenzartikel sind für Angehörige der Gesundheitsberufe bestimmt. Sie werden von britischen Ärzten verfasst und basieren auf Forschungsergebnissen, britischen und europäischen Leitlinien. Vielleicht finden Sie einen unserer Gesundheitsartikel nützlicher.
In diesem Artikel:
Lesen Sie unten weiter
Was ist ein Vorhofseptumdefekt?
Der Vorhofseptumdefekt (ASD) ist ein Herzfehler, der eine Verbindung zwischen der linken und der rechten Seite des Herzens ermöglicht. Diese interatrialen Verbindungen können durch Defekte in der Vorhofscheidewand, aber auch durch Defekte in den atrialen Verbindungen der systemischen oder pulmonalen Venen (Sinus venosus oder Koronarsinusdefekte) entstehen.
Das offene Foramen ovale ist ein häufiger angeborener Vorhofseptumdefekt mit einer Inzidenz von 15-35 % in der erwachsenen Bevölkerung. Die Entwicklung des interatrialen Septums ist erst nach der Geburt abgeschlossen. Bei 75 % der Allgemeinbevölkerung schließt sich das Foramen ovale nach der Geburt, und es verbleibt nur eine ovale Vertiefung, die so genannte Fossa ovalis, auf der rechten Seite der Vorhofscheidewand (Septum interatriale). Ein offenes Foramen ovale kann mit verschiedenen klinisch bedeutsamen Erkrankungen in Verbindung gebracht werden, darunter Migräne und Schlaganfall oder Dekompressionskrankheit bei Tauchern.1
Wie häufig ist der Vorhofseptumdefekt? (Epidemiologie)2 3
ASDs sind die dritthäufigste angeborene Herzerkrankung und treten als isolierte Anomalie in 5 bis 10 % aller angeborenen Herzfehler auf. Etwa 30 bis 50 % der Kinder mit angeborenen Herzfehlern haben einen ASD als Teil ihres Herzfehlers. Mit der verbesserten Erkennung von stummen Defekten durch Echokardiographie scheint die Inzidenz zu steigen.
Die Inzidenz ist bei Frauen höher, und bei den häufigen Ostium-secundum-Defekten beträgt das Verhältnis zwischen Frauen und Männern 2:1.
Lesen Sie unten weiter
Assoziierte Bedingungen
Die meisten ASDs treten sporadisch auf und haben keine definierte Ursache. Es wurden jedoch bekannte Häufungen von sekundären ASDs mit verschiedenen Formen der Vererbung gemeldet, am häufigsten autosomal dominant.
Das Risiko einer sekundären ASD ist in Familien mit einer Vorgeschichte von angeborenen Herzerkrankungen erhöht, insbesondere wenn eine ASD bei einem Geschwisterkind vorliegt.4
Secundum-ASDs treten bei vielen Syndromen auf, darunter das Holt-Oram-Syndrom, das Noonan-Syndrom und das Ellis-van-Creveld-Syndrom. Sowohl Secundum- als auch Primum-ASDs sind beim Down-Syndrom häufig.5
Das fetale Alkoholsyndrom, mütterliches Rauchen im ersten Trimester und mütterlicher Diabetes können alle mit ASDs in Verbindung gebracht werden.
Klassifizierung6
Die Entwicklung des Vorhofseptums ist ein komplexer Prozess und bildet die Grundlage für die Klassifizierung der interatrialen Kommunikation. Die Vorhofseptumbildung umfasst das Septum primum, das Septum secundum und das Septum des Atrioventrikularkanals.
Die normale Entwicklung des Vorhofseptums führt zur Bildung der Fossa ovalis, einer ovalen Vertiefung zwischen dem Septum secundum und dem Septum primum. Andere Teile des Septums sind das Sinus-venosus-Septum und das Koronarsinus-Septum.
Die folgenden Arten der interatrialen Kommunikation werden beschrieben
Patent foramen ovale - dies ist eine normale Verbindung im fötalen Leben und ist der Raum zwischen einem angemessen entwickelten Septum primum und einem normalen Septum secundum.
Secundum ASD - dies ist die häufigste Form des ASD und macht 50 bis 70 % aller ASDs aus. Der Secundum ASD ist ein Defekt innerhalb der Fossa ovalis, der durch einen oder mehrere Defekte im Septum primum entsteht.
Primum ASD - dies ist eine der Varianten der atrioventrikulären Septumdefekte (AVSDs) und wird auch als partieller AVSD bezeichnet, da er mit dem Vorhandensein einer gemeinsamen atrioventrikulären Öffnung verbunden ist. Der Defekt in der Vorhofscheidewand liegt zwischen dem unteren Rand der Fossa ovalis und den Atrioventrikularklappen. Ein isolierter primärer ASD tritt bei 15 % aller ASDs auf.
Sinus-Venosus-Defekt - das Gewebe, das die rechten Lungenvenen von der Vena cava superior und der angrenzenden freien Vorhofwand trennt, wird als Sinus-Venosus bezeichnet, und ein Defekt in diesem Bereich führt zu einem Sinus-Venosus-Defekt. Dies macht etwa 10 % aller ASDs aus.
Koronarsinusdefekt - dieser entsteht durch eine teilweise oder vollständige Ablösung des Gewebes, das den Koronarsinus vom linken Vorhof trennt, wodurch ein Shunt durch den Defekt und die Öffnung des Koronarsinus entstehen kann.
Interatrialseptum
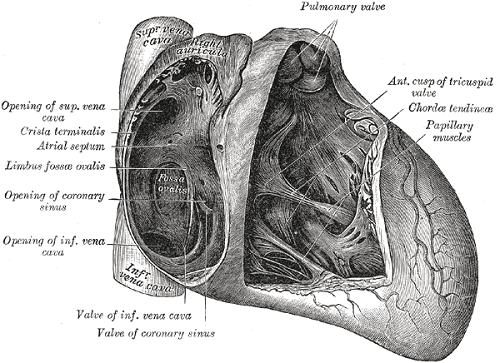
Lesen Sie unten weiter
Symptome eines Vorhofseptumdefekts (Darstellung)3
Die meisten Kinder mit isolierten Vorhofseptumdefekten sind symptomfrei, aber die Rate an Belastungsintoleranz, Vorhoftachyarrhythmien, rechtsventrikulärer Dysfunktion und pulmonaler Hypertonie steigt mit zunehmendem Alter, und die Lebenserwartung ist bei Erwachsenen mit unbehandelten Defekten reduziert.
Säuglinge und Kinder mit ASD sind in der Regel asymptomatisch.
In seltenen Fällen können Säuglinge mit Tachypnoe, geringer Gewichtszunahme und wiederkehrenden Brustinfektionen auftreten. In all diesen Fällen sollte gründlich nach nicht-kardialen Erkrankungen und pulmonaler Hypertonie gesucht werden.7
Subtile Symptome wie Kurzatmigkeit bei Belastung oder Herzklopfen können bei einigen Patienten im zweiten Lebensjahrzehnt auftreten.
Die meisten erwachsenen Patienten mit einem großen Defekt zeigen Symptome wie Müdigkeit, Belastungsintoleranz, Herzklopfen, Synkopen, Kurzatmigkeit, periphere Ödeme, thromboembolische Erscheinungen und Zyanose.
Herzrhythmusstörungen sind bei Kindern selten, treten aber nach dem 40. Lebensjahr immer häufiger auf. Die häufigsten Herzrhythmusstörungen sind Vorhofflattern und Vorhofflimmern.
Eine pulmonale Hypertonie ist bei Kindern mit isoliertem ASD selten, aber eine leichte oder mäßige pulmonale Hypertonie ist bei Erwachsenen mit großen Defekten häufig und nimmt mit dem Alter tendenziell zu.
Eine pulmonale Gefäßverengung mit oder ohne Umkehrung des Vorhofshunts (Eisenmenger-Syndrom) entwickelt sich bei 5 % bis 10 % der Erwachsenen mit unbehandelten ASDs.8
Physische Anzeichen eines Vorhofseptumdefekts9
Die meisten Säuglinge und Kinder mit einer ASD erscheinen gesund und rosig.
Die charakteristischen auskultatorischen Befunde werden wie folgt beschrieben:
Weit gespreiztes Sekundenherzgeräusch ohne Atemschwankungen.
Leises systolisches Auswurfgeräusch (Grad 2 bis 3) im Bereich der Lunge am oberen linken Sternumrand.
Ein diastolisches Rumpeln über dem linken unteren Brustbein aufgrund eines verstärkten Flusses durch die Trikuspidalklappe bei Personen mit einem großen Shunt.
Klassische auskultatorische Befunde, wie sie oben beschrieben wurden, sind nicht vorhanden, es sei denn, der Shunt ist relativ groß. Die Befunde können bei vielen Säuglingen und Kindern fehlen, selbst bei denen mit einem großen Defekt, wenn der rechte Ventrikel nur wenig nachgiebig ist. Klassische auskultatorische Befunde sind bei Erwachsenen mit großen Shunts sehr viel wahrscheinlicher.
Anzeichen einer Rechtsherzinsuffizienz sind selten, können aber bei Erwachsenen mit pulmonaler Hypertonie auftreten.
Untersuchungen9 10
EKG
Das EKG kann bei Säuglingen und Kindern mit kleinen Shunts normal sein.
Typische Befunde sind eine hohe P-Welle, die auf eine Vergrößerung des rechten Vorhofs hinweist, ein unvollständiges Rechtsschenkelblockmuster (rsR' in V1) und eine Rechtsachsenabweichung.
Eine linke Achsenabweichung mit einer superioren Achse deutet auf einen Primumdefekt hin.
Eine Hypertrophie des rechten Ventrikels wird bei Patienten mit pulmonaler Hypertonie beobachtet.
Bei Erwachsenen können Vorhofflattern oder Vorhofflimmern auftreten.
CXR
Das CXR ist bei Säuglingen und Kindern mit kleinen Shunts normal.
Bei Patienten mit hämodynamisch bedeutsamen ASDs kann eine Kardiomegalie mit Vergrößerung des rechten Atriums und der rechten Herzkammer vorliegen.
Ein vorstehendes Pulmonalarteriensegment und verstärkte pulmonale Gefäßmarkierungen sind bei Patienten mit einem signifikanten Shunt zu sehen.
Echokardiographie
Die transthorakale Echokardiographie ist in der Regel diagnostisch und kann die Lage, Größe und hämodynamischen Eigenschaften des Defekts aufzeigen. Die zweidimensionale Bildgebung zeigt die Lage und Größe des ASD, während der Doppler (Farbe und Puls) Flussrichtung und Flussgeschwindigkeit liefert. Die Messung der Größe des rechten Vorhofs, des rechten Ventrikels und der Lungenarterie hilft bei der Beurteilung der hämodynamischen Auswirkungen.
Die dreidimensionale Echokardiographie kann zusätzliche Informationen über die Form des Defekts und die Veränderung seiner Größe während des Herzzyklus liefern.
Bei älteren Kindern und Erwachsenen, insbesondere wenn sie übergewichtig sind, ist eine adäquate Darstellung der Vorhofscheidewand mit der transthorakalen Echokardiographie möglicherweise nicht möglich. In solchen Fällen ist die transösophageale Echokardiographie (TOE) sehr nützlich.
Die Kontrastechokardiographie mit Injektion von bewegter Kochsalzlösung über eine periphere Venenleitung kann bei der Diagnose von ASD bei Patienten mit eingeschränktem Schallfenster hilfreich sein.11
MRI und CT
Mit der kardialen MRT lässt sich die Anatomie von ASDs genau definieren und ihre hämodynamischen Auswirkungen quantitativ bewerten. Obwohl sie für isolierte secundum- oder primum-ASDs nur selten benötigt wird, ist die kardiale MRT ein sehr nützliches Diagnoseinstrument für ASDs des Sinus venosus, die mit der Echokardiographie schwer zu beurteilen sind.12
Die hochauflösende Kontrastmittel-CT kann hervorragende anatomische Informationen liefern, wird aber wegen des damit verbundenen Strahlungsrisikos nur selten eingesetzt.13
Herzkatheterisierung
Die Katheterisierung wird bei ASDs nur selten als diagnostisches Mittel eingesetzt und dient in der Regel dem interventionellen Verschluss des Defekts.
Eine diagnostische Katheterisierung ist bei Patienten mit pulmonaler Hypertonie und bei Erwachsenen mit dem Risiko einer koronaren Herzkrankheit angezeigt.
Differentialdiagnose
Die Diagnose von ASD wird oft verzögert gestellt, da das Geräusch sehr leise ist und leicht mit einem unschuldigen Geräusch verwechselt werden kann.
Das Geräusch der Pulmonalstenose ist sehr ähnlich.
Behandlung und Management von Vorhofseptumdefekten14
Der chirurgische Verschluss ist sicher und wirksam, und wenn er vor dem Alter von 25 Jahren durchgeführt wird, ist er mit einer normalen Lebenserwartung verbunden. Bei Asymptomatik wird der Verschluss normalerweise im Alter von 4 bis 5 Jahren durchgeführt. Obwohl der ASD-Verschluss bei Erwachsenen nicht unumstritten ist, wird empfohlen, den ASD zum Zeitpunkt der Vorstellung zu verschließen.
Der Transkatheterverschluss bietet eine weniger invasive Alternative für Patienten mit einem Secundumdefekt, die anatomische und Größenkriterien erfüllen.3 Bei Ostium-secundum-Defekten hat sich der Transkatheterverschluss als ebenso wirksam erwiesen wie der chirurgische Verschluss. Die übrigen Arten von ASDs erfordern in der Regel eine chirurgische Korrektur.
Medizinisches Management
Bei Kindern mit ASD ist eine Bewegungseinschränkung nicht erforderlich.
Eine infektiöse Endokarditisprophylaxe ist nicht indiziert, es sei denn, es liegt ein Mitralklappenprolaps oder ein anderer assoziierter Defekt vor. Bei Patienten mit isoliertem ASD besteht kein Risiko für die Entwicklung einer infektiösen Endokarditis.15
Bei der geringen Zahl von Kindern, die eine Herzinsuffizienz entwickeln, kann eine Behandlung mit Diuretika erforderlich sein.
Ein hämodynamisch signifikanter ASD sollte nach Bestätigung der Diagnose elektiv verschlossen werden. Obwohl dies auch bei kleinen Kindern möglich ist, werden die Defekte nach der derzeitigen britischen Praxis im Alter von 4-5 Jahren verschlossen.
Erwachsene mit spät diagnostizierten und nicht reparierten Defekten müssen möglicherweise wegen Herzinsuffizienz und Vorhofflattern oder Vorhofflimmern behandelt werden.
Chirurgischer Verschluss16
Zu den ASDs, die nur chirurgisch verschlossen werden können, gehören der Sinus venosus, der Koronarsinus und der Primum septale Defekt. Secundum-ASDs können entweder chirurgisch oder mit einem Transkathetergerät verschlossen werden. Bei kleinen Säuglingen und sehr großen Defekten ist ein Geräteverschluss möglicherweise nicht möglich.
Der chirurgische Verschluss erfolgt unter direkter Sicht und unter Verwendung eines kardiopulmonalen Bypasses, entweder durch direkte Naht oder durch Verwendung eines Perikard- oder Kunststoffpatches. Es sind verschiedene chirurgische Zugänge möglich, darunter ein Sternumschnitt in der Mittellinie und eine seitliche Thorakotomie.
Video-assistierte thorakoskopische Verfahren sind machbar und ermöglichen Operationen über einen viel kleineren Schnitt mit besseren kosmetischen Ergebnissen.17
Der chirurgische Verschluss von ASDs ist seit Jahrzehnten eine Standardbehandlung. Seit den ersten Berichten über den chirurgischen ASD-Verschluss im Jahr 1948 haben mehr als 70 Jahre Erfahrung zu einem sicheren und effektiven Eingriff mit minimaler Sterblichkeit und minimalen Komplikationen geführt.18
Transkatheter-Verschluss19
Der Transkatheterverschluss ist mittlerweile eine anerkannte Alternative zur chirurgischen Reparatur von Vorhofseptumdefekten. Große ASDs (>38 mm) und Defekte mit mangelhaften Rändern werden jedoch in der Regel zum chirurgischen Verschluss überwiesen. Auch bei anderen komplizierten ASDs mit Komorbiditäten, zusätzlichen kardialen Merkmalen und bei kleinen Kindern ist der Transkatheterverschluss nach wie vor umstritten.20
Seit dem ersten Transkatheterverschluss von ASD im Jahr 1976 hat es mit der Entwicklung mehrerer neuer Geräte und Einführungssysteme erhebliche Fortschritte auf diesem Gebiet gegeben. In vielen Zentren hat der Transkatheterverschluss die Operation als bevorzugte Methode abgelöst.
Nicht alle ASDs können mit dieser Methode verschlossen werden; zu den relativen Kontraindikationen gehören:21
Defekte mit einem maximalen Durchmesser von mehr als 40 mm.
Defekte mit unzureichenden Rändern, um das Gerät zu stützen.
Beeinträchtigung der atrioventrikulären Klappenfunktion oder des pulmonalen oder systemischen venösen Abflusses durch das Gerät.
Jüngste Daten bestätigen, dass der apparative Verschluss von sekundären ASDs bei Kindern sicher und wirksam ist, mit einem technischen Erfolg von 96 % und einer Verschlussrate von 99,6 % nach 24 Stunden.22 Bei Erwachsenen, die sich einem Transkatheterverschluss von ASDs unterziehen, wurden ähnlich gute Ergebnisse festgestellt. Das National Institute for Health and Care Excellence (NICE) hat detaillierte Leitlinien herausgegeben und unterstützt die Anwendung dieses Verfahrens.23
Die Komplikationsraten sind niedrig und liegen bei etwa 1,1 % für schwerwiegende Komplikationen (Embolie des Geräts, die eine Operation erfordert, oder Herzbeuteltamponade) und 4,8 % für geringfügige Komplikationen (Vorhofarrhythmien, vaskuläre Komplikationen und vorübergehender Herzblock).22
Spätkomplikationen sind selten, aber es wurde über Vorhofarrhythmien, Schlaganfall, Gerätethrombose, Geräteerosion durch die Vorhofwand oder die Aortenwurzel, Geräteembolisation und Tod berichtet.
Studien, die den Transkatheterverschluss und den chirurgischen Verschluss in Bezug auf Ergebnis, Wirksamkeit, Komplikationen und Kosten vergleichen, haben gezeigt, dass beide Methoden gleichwertig sind.24
Endokarditis-Prophylaxe15
Dies ist bei isolierten ASDs nicht erforderlich.
Prognose25
Isolierte Vorhofseptumdefekte, die im Kindesalter repariert werden, haben eine ausgezeichnete Prognose und eine ähnliche Überlebensrate wie die der Allgemeinbevölkerung.
Isolierte ASDs, die erst im späten Erwachsenenalter diagnostiziert werden, führen zu zunehmenden Symptomen wie Müdigkeit, Kurzatmigkeit, Herzklopfen und Anzeichen von Herzinsuffizienz, die die Überlebensrate verringern. Der Shunt verschlimmert sich bei Erwachsenen mit verminderter linksventrikulärer Compliance aufgrund einer koronaren Herzerkrankung oder Bluthochdruck. Vorhofflattern und Vorhofflimmern sind ebenfalls häufig.
Das Risiko der Entwicklung einer pulmonalen Gefäßerkrankung, einer potenziell tödlichen Komplikation, ist bei weiblichen Patienten und bei älteren Erwachsenen mit unbehandelten Defekten höher.3
Die Reparatur von ASDs verbessert die Prognose, auch wenn sie nach dem 40. Lebensjahr durchgeführt wird, und verringert die Morbidität und Mortalität. Es kommt zu einer allgemeinen Verbesserung der Symptome und der körperlichen Leistungsfähigkeit. Allerdings bleibt das Risiko von Vorhofflattern und Vorhofflimmern hoch.
Vorhofseptumdefekt und Schwangerschaft
Bei Frauen mit isolierten ASDs (repariert und nicht repariert) ist eine Schwangerschaft nicht mit einem signifikanten Anstieg der mütterlichen Komplikationen verbunden. Es besteht ein geringes Risiko für Herzrhythmusstörungen und transitorische ischämische Attacken. Bei Frauen mit nicht reparierten Defekten ist das Risiko einer Präeklampsie, eines fetalen Verlusts und eines niedrigen Geburtsgewichts höher als in der Allgemeinbevölkerung.26
Die Müttersterblichkeit ist bei Frauen mit einem ASD und schwerer pulmonaler Hypertonie bemerkenswert hoch. Eine Schwangerschaft sollte bei diesen Frauen vermieden werden.27
Weiterführende Literatur und Referenzen
- Le Gloan L, Legendre A, Iserin L, et alPathophysiologie und natürlicher Verlauf des Vorhofseptumdefekts. J Thorac Dis. 2018 Sep;10(Suppl 24):S2854-S2863. doi: 10.21037/jtd.2018.02.80.
- Romano V, Gallinoro CM, Mottola R, et alPatent Foramen Ovale - ein nicht so harmloser Vorhofseptumdefekt bei Erwachsenen. J Cardiovasc Dev Dis. 2021 May 25;8(6):60. doi: 10.3390/jcdd8060060.
- Hoffman JI, Kaplan SDie Inzidenz angeborener Herzkrankheiten. J Am Coll Cardiol. 2002 Jun 19;39(12):1890-900.
- Geva T, Martins JD, Wald RMVorhofseptumdefekte. Lancet. 2014 May 31;383(9932):1921-32. doi: 10.1016/S0140-6736(13)62145-5. Epub 2014 Apr 8.
- Caputo S, Capozzi G, Russo MG, et alFamiliäres Wiederauftreten von angeborenen Herzerkrankungen bei Patienten mit ostium secundum Vorhofseptumdefekt. Eur Heart J. 2005 Oct;26(20):2179-84. Epub 2005 Jun 24.
- Dennis J, Archer N, Ellis J, et alErkennen von Herzerkrankungen bei Kindern mit Down-Syndrom. Arch Dis Child Educ Pract Ed. 2010 Aug;95(4):98-104. doi: 10.1136/adc.2007.126672.
- Briggs LE, Kakarla J, Wessels ADie Pathogenese atrialer und atrioventrikulärer Septumdefekte unter besonderer Berücksichtigung der Rolle der dorsalen mesenchymalen Ausstülpung. Differentiation. 2012 Jul;84(1):117-30. doi: 10.1016/j.diff.2012.05.006. Epub 2012 Jun 17.
- Goetschmann S, Dibernardo S, Steinmann H, et alHäufigkeit einer schweren pulmonalen Hypertonie als Komplikation eines "isolierten" Vorhofseptumdefekts im Säuglingsalter. Am J Cardiol. 2008 Aug 1;102(3):340-2. doi: 10.1016/j.amjcard.2008.03.061. Epub 2008 May 2.
- Sachweh JS, Daebritz SH, Hermanns B, et alHypertensive pulmonale Gefäßerkrankung bei Erwachsenen mit secundum oder sinus venosus Vorhofseptumdefekt. Ann Thorac Surg. 2006 Jan;81(1):207-13.
- Martin SS, Shapiro EP, Mukherjee MVorhofseptumdefekte - klinische Manifestationen, Echobewertung und Intervention. Clin Med Insights Cardiol. 2015 Mar 23;8(Suppl 1):93-8. doi: 10.4137/CMC.S15715. eCollection 2014.
- Torres AJHämodynamische Bewertung von Vorhofseptumdefekten. J Thorac Dis. 2018 Sep;10(Suppl 24):S2882-S2889. doi: 10.21037/jtd.2018.02.17.
- Soliman OI, Geleijnse ML, Meijboom FJ, et alDie Verwendung der Kontrastechokardiographie zur Erkennung von kardialen Shunts. Eur J Echocardiogr. 2007 Jun;8(3):S2-12. Epub 2007 Apr 25.
- Prompona M, Muehling O, Naebauer M, et alMRT zur Erkennung anomaler pulmonalvenöser Drainagen bei Patienten mit Sinus-Venosus-Vorhofseptumdefekten. Int J Cardiovasc Imaging. 2011 Mar;27(3):403-12. doi: 10.1007/s10554-010-9675-3. Epub 2010 Aug 5.
- Johri AM, Rojas CA, El-Sherief A, et alBildgebung von Vorhofseptumdefekten: Korrelation von Echokardiographie und CT. Heart. 2011 Sep;97(17):1441-53. doi: 10.1136/hrt.2010.205732.
- Rao PS, Harris ADAktuelle Fortschritte bei der Behandlung von Septumdefekten: Vorhofseptumdefekte. F1000Res. 2017 Nov 22;6:2042. doi: 10.12688/f1000research.11844.1. eCollection 2017.
- Prophylaxe gegen infektiöse Endokarditis: Antimikrobielle Prophylaxe gegen infektiöse Endokarditis bei Erwachsenen und Kindern, die sich interventionellen Verfahren unterziehenNICE Clinical Guideline (März 2008 - zuletzt aktualisiert im Juli 2016)
- Liava'a M, Kalfa DChirurgischer Verschluss von Vorhofseptumdefekten. J Thorac Dis. 2018 Sep;10(Suppl 24):S2931-S2939. doi: 10.21037/jtd.2018.07.116.
- Suematsu Y, Kiaii B, Bainbridge DT, et alRobotergestützter Verschluss von Vorhofseptumdefekten unter dreidimensionaler Echtzeit-Echoführung: In-vitro-Studie. Eur J Cardiothorac Surg. 2007 Oct;32(4):573-6. Epub 2007 Aug 15.
- Noiri JI, Konishi H, Matsuzoe HDie Bedeutung der Untersuchung des Vorhofseptums vor der Ablation bei Patienten mit chirurgischem Patch-Verschluss in der Vergangenheit. J Arrhythm. 2023 Feb 20;39(2):224-226. doi: 10.1002/joa3.12829. eCollection 2023 Apr.
- O'Byrne ML, Levi DSStand der Technik: Vorhofseptumdefekt-Verschlussgeräte für angeborene Herzen. Interv Cardiol Clin. 2019 Jan;8(1):11-21. doi: 10.1016/j.iccl.2018.08.008.
- Fraisse A, Latchman M, Sharma SR, et alVerschluss von Vorhofseptumdefekten: Indikationen und Kontraindikationen. J Thorac Dis. 2018 Sep;10(Suppl 24):S2874-S2881. doi: 10.21037/jtd.2018.08.111.
- Marie Valente A, Rhodes JFAktuelle Indikationen und Kontraindikationen für den transkathetergestützten Verschluss von Vorhofseptumdefekten und offenen Foramen ovale. Am Heart J. 2007 Apr;153(4 Suppl):81-4.
- Everett AD, Jennings J, Sibinga E, et alGemeinschaftlicher Einsatz des Amplatzer-Atrialseptumdefekt-Verschlusses: Ergebnisse der multizentrischen MAGIC-Atrialseptumdefekt-Studie. Pediatr Cardiol. 2009 Apr;30(3):240-7. doi: 10.1007/s00246-008-9325-x. Epub 2008 Nov 18.
- Endovaskulärer Verschluss eines VorhofseptumdefektsNICE Leitfaden für interventionelle Verfahren, Oktober 2004
- Kutty S, Hazeem AA, Brown K, et alLangfristige (5- bis 20-jährige) Ergebnisse nach Transkatheter- oder chirurgischer Behandlung eines hämodynamisch signifikanten isolierten sekundären Vorhofseptumdefekts. Am J Cardiol. 2012 May 1;109(9):1348-52. doi: 10.1016/j.amjcard.2011.12.031. Epub 2012 Feb 13.
- Lindsey JB, Hillis LDKlinisches Update: Vorhofseptumdefekt bei Erwachsenen. Lancet. 2007 Apr 14;369(9569):1244-6.
- Drenthen W, Pieper PG, Roos-Hesselink JW, et alSchwangerschaftsverlauf bei Frauen mit angeborenen Herzfehlern: eine Literaturübersicht. J Am Coll Cardiol. 2007 Jun 19;49(24):2303-11. Epub 2007 Jun 4.
- Bowater SE, Thorne SAManagement der Schwangerschaft bei Frauen mit erworbenen und angeborenen Herzkrankheiten. Postgrad Med J. 2010 Feb;86(1012):100-5.
Lesen Sie unten weiter
Artikel Geschichte
Die Informationen auf dieser Seite wurden von qualifizierten Klinikern verfasst und von Fachleuten geprüft.
Nächste Überprüfung fällig: 19 April 2028
21 Apr 2023 | Neueste Version
26 Jan 2015 | Ursprünglich veröffentlicht
Verfasst von:
Dr. Anjum Gandhi, FRCPCH

Fragen, teilen, verbinden.
Stöbern Sie in Diskussionen, stellen Sie Fragen, und tauschen Sie Erfahrungen zu Hunderten von Gesundheitsthemen aus.

Fühlen Sie sich unwohl?
Beurteilen Sie Ihre Symptome online und kostenlos