Hereditäre Netzhautdystrophien
Begutachtet von Dr. Philippa Vincent, MRCGPZuletzt aktualisiert von Dr. Colin Tidy, MRCGPZuletzt aktualisiert am 21. Juli 2023
Erfüllt die Anforderungen des Patienten redaktionelle Richtlinien
- HerunterladenHerunterladen
- Teilen Sie
- Sprache
- Diskussion
Medizinisches Fachpersonal
Professionelle Referenzartikel sind für Angehörige der Gesundheitsberufe bestimmt. Sie wurden von britischen Ärzten verfasst und basieren auf Forschungsergebnissen, britischen und europäischen Leitlinien. Vielleicht finden Sie den Artikel über Sehstörungen nützlicher oder einen unserer anderen Gesundheitsartikel.
In diesem Artikel:
Lesen Sie unten weiter
Übersicht1
Hereditäre Netzhautdystrophien sind eine große Gruppe erblicher Augenkrankheiten, die zu einem irreversiblen Sehverlust führen. Sie entstehen aufgrund von Mutationen in einem oder mehreren Genen, die zum Absterben der Photorezeptorzellen der Netzhaut führen. Es ist bekannt, dass Mutationen in über 200 Genen mit den verschiedenen Formen von Netzhauterkrankungen in Verbindung gebracht werden.
Zu den therapeutischen Möglichkeiten, die für diese Erkrankungen untersucht werden, gehören die Gentherapie, um das defekte Gen zu ersetzen, die Behandlung mit neurotrophen Faktoren, um das Wachstum der Photorezeptoren anzuregen, die Zellersatztherapie und prothetische Geräte, die Licht einfangen und elektrische Signale über die Neuronen der Netzhaut an das Gehirn weiterleiten können. Eine Kombination von Ansätzen, die sowohl Gen- als auch Zellersatz beinhalten, kann für einen optimalen Nutzen erforderlich sein.
Retinitis pigmentosa ist die häufigste Netzhautdystrophie und betrifft 1 von 3.000 Personen. Die meisten Retinitis-Pigmentosa-Mutationen betreffen selektiv die Stäbchen. Siehe separater Artikel über Retinitis pigmentosa.
Im Gegensatz zur Retinitis pigmentosa, bei der die Degeneration der Stäbchen zunächst die periphere Netzhaut betrifft, ist bei vielen erblichen Netzhautdystrophien in erster Linie die Makula betroffen. Makuladystrophien sind durch einen allmählichen Verlust der Sehschärfe, des Farbensehens und der Kontrastempfindlichkeit gekennzeichnet, der in der Regel im zweiten Lebensjahrzehnt einsetzt. Es gibt eine Vielzahl von (sich oft überschneidenden) Bezeichnungen.
Eine korrekte Diagnose ist wichtig, da sie über die zu erwartende Prognose entscheidet. Eine spezifische Gentherapie für eine Reihe von Krankheiten wird derzeit geprüft.2
Anatomie der Netzhaut
Die Netzhaut ist eine vielschichtige Struktur, und Netzhautdystrophien können jede dieser Schichten betreffen. Vom Glaskörper bis zur Aderhaut sind dies die innere Begrenzungsmembran, die Nervenfaserschicht, die Ganglienzellenschicht, die innere plexiforme Schicht, die innere Kernschicht, die äußere plexiforme Schicht, die äußere Kernschicht, die äußere Begrenzungsmembran, die inneren und äußeren Stäbchen- und Zapfensegmente und das retinale Pigmentepithel (RPE).
Die Makula weist eine hohe Dichte an Zapfen, Ganglienzellen und Pigmenten in den Bipolar- und Ganglienzellen auf. Der zentrale 1,5 mm große Bereich der Makula ist die Fovea. Innerhalb der Fovea befindet sich ein etwa kreisförmiger avaskulärer Bereich, die foveale avaskuläre Zone, die nur Zapfen enthält.
Anatomie der Netzhaut
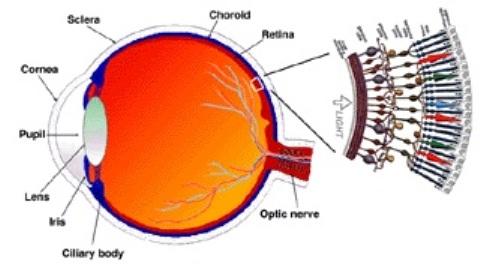
Über Wikimedia Commons
Lesen Sie unten weiter
Hereditäre Netzhautdystrophien Symptome (Darstellung)2
Dies ist je nach Krankheit unterschiedlich. In der Netzhaut gibt es 60-125 Millionen Stäbchen und 3,2-6,5 Millionen Zapfen. In der Fovea sind keine Stäbchen vorhanden, obwohl die höchste Dichte an Stäbchen in einem Abstand von etwa 20° von der Fovea zu finden ist. Die Zapfen sind hauptsächlich in der Fovea konzentriert und liegen am dichtesten innerhalb der Foveola. Daher verursachen Krankheiten, die die Stäbchen betreffen, eher nächtliche Sehprobleme und periphere Gesichtsfelddefekte. Krankheiten, die die Zapfen betreffen, führen zu erhöhter Lichtempfindlichkeit, Verlust des zentralen Sehens, beeinträchtigtem Farbensehen und zentralen Gesichtsfelddefekten.
Diagnose2
Die Diagnose wird in der Regel anhand der klinischen Untersuchung und subjektiver Tests gestellt, muss aber durch elektrodiagnostische Tests bestätigt werden. Dies trägt dazu bei, die Netzhauterkrankung von der Aderhauterkrankung zu unterscheiden und die Genauigkeit der Diagnose zu gewährleisten (wichtig angesichts der genetischen Auswirkungen).
Die Fundoskopie - auch mit rotfreiem Licht -, Gesichtsfeldtests, elektrophysiologische Tests und multifokale Elektroretinogramme (ERGs) sowie Tests zur Beurteilung des Farbsehens können bei der Diagnose helfen.
Subjektive Netzhauttests
Farbsehtests: Der bekannteste Test ist der Ishihara-Test, der zwischen roter und grüner Farbenblindheit unterscheidet. Andere, anspruchsvollere Tests können gelbe Farbenblindheit feststellen und helfen, komplexe und subtile Grade der Farbenblindheit zu diagnostizieren.
Die Dunkeladaptometrie ist nützlich für Patienten, die über Nachtblindheit (Nyktalopie) klagen - ein häufiges Merkmal dieser Störungen.
Objektive Beurteilung der Netzhaut
Die Fluoreszeinangiographie kann helfen, eine Netzhaut- von einer Aderhauterkrankung zu unterscheiden.
ERGs zeichnen das von der Netzhaut als Reaktion auf Licht erzeugte Aktionspotenzial auf und zeigen typische Muster bei Dunkelheit (skotopisch) und Licht (photopisch). Abweichungen von normalen Wellen helfen bei der Diagnose, ähnlich wie bei einem EKG. Bei dem Test wird eine Elektrode auf der Hornhaut platziert, um die elektrischen Reaktionen der Netzhaut auf Licht zu messen.
Elektrookulogramme (EOGs) ergänzen die ERG-Messungen. Sie messen das stehende Potenzial zwischen der elektrisch positiven Hornhaut und dem elektrisch negativen Augenhintergrund. Ein abnormales EOG entsteht als Folge von Problemen im RPG.
Neue Methoden wie die hochauflösende optische Kohärenztomographie im Spektralbereich (SD-OCT) und die Fundusautofluoreszenz werden derzeit evaluiert.
Genetische Tests2
Herkömmliche Gentests wären teuer und zeitaufwändig, da bei den verschiedenen Dystrophien Mutationen in mehr als 200 Genen beteiligt sind. Neue Gentestmethoden bieten die Möglichkeit, mehrere Gene zu analysieren. Diese Methoden ermöglichen wesentlich schnellere und kostengünstigere Analysen.
Lesen Sie unten weiter
Hereditäre Netzhautdystrophien - Behandlung und Management 2 3
Die Behandlung konzentriert sich auf die Diagnose und spezielle genetische Beratung. Die Behandlungsmöglichkeiten sind begrenzt und konzentrieren sich in der Regel auf die optometrische visuelle Rehabilitation (z. B. Verwendung von Hilfsmitteln für geringes Sehvermögen, Orientierungs- und Mobilitätstraining). Auch auf dem Gebiet der Molekular- und Gentherapie wird gearbeitet, da die verantwortlichen Gene zunehmend identifiziert werden.
Die Verfügbarkeit und Bereitstellung der hochspezialisierten multidisziplinären Dienste, die Patienten benötigen, ist im Vereinigten Königreich unterschiedlich.
Es gibt vielversprechende Forschungsergebnisse auf dem Gebiet der Gentherapie. So haben Studien bei der Leberschen kongenitalen Amaurose, die mit einer Funktionsstörung und Degeneration der Photorezeptoren einhergeht, einige positive Auswirkungen der Gentherapie gezeigt.
Beispiele für erbliche Netzhauterkrankungen4
Es gibt eine Vielzahl von erblichen Netzhautdystrophien, von denen einige sehr selten sind. Kennzeichnend ist ein Verlust der Sehschärfe. Diese Erkrankungen sind eine der Hauptursachen für schwere Sehbehinderungen und betreffen Patienten aller Altersgruppen. Sie unterscheiden sich sowohl auf genetischer Ebene als auch auf klinischer, histologischer und physiopathologischer Ebene. Die laufende genetische Forschung trägt dazu bei, das Verständnis der Pathophysiologie weiter zu verbessern.
Morbus Stargardt und Fundus flavimaculatus2
Es ist umstritten, ob es sich bei dieser Erkrankung um zwei Krankheiten oder um eine einzige handelt. Morbus Stargardt oder Fundus flavimaculatus ist eine progressive Form der juvenilen Makuladegeneration mit klinischer und genetischer Heterogenität. Mutationen in mindestens vier Genen sind für ähnliche klinische Merkmale verantwortlich, und es fehlt eine klare diagnostische Unterscheidung zwischen ihnen. Morbus Stargardt und Fundus Flavimaculatus werden hier als eine Entität diskutiert.
Die Stargardt-Krankheit, mit oder ohne Fundus flavimaculatus, ist die häufigste erbliche Dystrophie der zentralen Netzhaut und tritt bei 1 von 8.000-10.000 Menschen auf.5
Beschreibung - auch bekannt als juvenile Makuladystrophie: Dies ist eine der beiden häufigsten Formen der erblichen Makuladegeneration. Sie macht 7 % aller Netzhautdystrophien aus. Sie wurde erstmals 1909 von dem deutschen Augenarzt Karl Stargardt beschrieben. Es handelt sich um eine fortschreitende, bilaterale atrophische Makuladystrophie, die durch perimakuläre und periphere "schmutzig-grau-gelbe Flecken" (Fundus flavimaculatus) gekennzeichnet ist.
Vererbung - hauptsächlich autosomal-rezessiv; es gibt eine seltene autosomal-dominante Variante.
Erscheinungsbild - Kindheit (im Alter von etwa 6 Jahren) bis ins frühe Erwachsenenalter: beidseitige (meist) Verminderung des zentralen Sehens. Diese steht oft in keinem Verhältnis zum Krankheitsbild. Es besteht auch eine fortschreitende Farbenblindheit.
Die Prognose ist im Allgemeinen schlecht. Bei den meisten Patienten kommt es in den ersten beiden Lebensjahrzehnten zu einer raschen Verschlechterung des Sehvermögens. Sobald das Sehvermögen unter 6/12 sinkt, schreitet die Krankheit schnell voran und die Prognose ist schlecht. Durch visuelle Rehabilitation kann ein gewisses Maß an Unabhängigkeit erreicht und erhalten werden.6
Eine Variante, die als Fundus flavimaculatus bezeichnet wird, tritt später auf, und die Makula kann verschont bleiben. Der Patient kann sich mit einer zentralen Sehverschlechterung vorstellen. Die Verschlechterung des Farbsehens wird möglicherweise erst später bemerkt. Die Verteilung und Anzahl der gelblichen Flecken kann sich im Laufe der Zeit verändern. Die Prognose ist in der Regel besser, und das periphere und das Nachtsehen sind nicht beeinträchtigt.
Juvenile Best-Krankheit (Best'sche vitelliforme Makuladystrophie)2
Die Best-Krankheit wurde 1906 von Friedrich Best entdeckt und ist die zweithäufigste erbliche Dystrophie der Makula.
Beschreibung: Kennzeichnend ist eine abnorme Anhäufung von Lipofuszin auf der Ebene des RPG. Diese Anhäufung wächst über Jahre hinweg und führt schließlich zu einem charakteristischen runden, eiergelben Aussehen, das später mit einem Pseudohypopyon verbunden sein kann.
Vererbung - Es handelt sich um eine progressive autosomal-dominante Erbkrankheit mit variabler Penetranz bei verschiedenen Mitgliedern derselben Familie. Die Mutation wurde im BEST1 (VMD2) Gen auf Chromosom 11 lokalisiert.
Erscheinungsbild - die Symptome können in den ersten beiden Lebensjahrzehnten auftreten. Die Sehschärfe verschlechtert sich, wenn die "Eigelb-Läsion" aufbricht. Bei Kindern treten Veränderungen der EOG-Werte auf, bevor sie symptomatisch werden. Das Sehvermögen kann in der Kindheit und im Teenageralter nur geringfügig vermindert sein, wenn die "Eigelb-Läsion" vorhanden ist. In der Regel ist das Sehvermögen bis zum fünften Lebensjahrzehnt nicht wesentlich beeinträchtigt.
Prognose - Die abnehmende Sehschärfe kann auf die Makulavernarbung zurückzuführen sein, aber auch andere Komplikationen können dazu beitragen (z. B. die Bildung von Makulaforamina oder Netzhautablösungen). Bei einigen Patienten kommt es zu einer schweren Sehbehinderung, doch die meisten behalten die Fähigkeit zum Lesen mit einem Auge.
Vitelliforme foveomakuläre Dystrophie bei Erwachsenen (vitelliforme Degeneration bei Erwachsenen)2 7
Beschreibung - Bei dieser Krankheit treten bilaterale, symmetrische Läsionen in der Makula auf. Sie ähneln denen der Best-Krankheit, sind aber kleiner, treten im Erwachsenenalter auf und schreiten nicht fort.
Vererbung - wahrscheinlich autosomal-dominant.
Präsentation - im Alter von 40-50 Jahren: verschwommenes Sehen ± Verzerrung der Bilder (Metamorphopsie), die so leicht sein kann, dass diese Erkrankung oft zufällig entdeckt wird.
Prognose - gut, sofern keine Komplikationen auftreten (z. B. Neovaskularisierung der darunter liegenden Aderhaut).
Andere hereditäre Makuladystrophien4
Die pseudo-inflammatorische Makuladystrophie nach Sorsby, die North Carolina Makuladystrophie und das dominante zystoide Makulaödem haben eine schlechte Prognose.
Bei der Schmetterlingsmakuladystrophie handelt es sich um eine relativ harmlose Erkrankung (die oft zufällig entdeckt wird), die zu einer leichten Beeinträchtigung des zentralen Sehens führt.
Die Musterdystrophie äußert sich in einer parazentralen Verzerrung und einem Verlust der Sehschärfe. Sie kann auch asymptomatisch sein. Am gesamten Augenhintergrund sind kleine gelbe Flecken zu sehen, die mit einer Makulaatrophie einhergehen.
Achromatopsie8
Beschreibung: Diese Erkrankung führt zu einem vollständigen Verlust der Zapfenfunktion, während die Stäbchenfunktion während des gesamten Krankheitsverlaufs normal ist. Die Prävalenz wird auf etwa 1:30.000 geschätzt. Da die Zapfen in der Fovea konzentriert sind, sind die Makula und die Fovea überproportional betroffen.
Vererbung - kongenitale Achromatopsie wird autosomal-rezessiv vererbt
Präsentation - Die Patienten treten in der frühen Kindheit mit Nystagmus, abnormalem Sehverhalten oder Photophobie auf. Die Sehschärfe beträgt weniger als 20/200. Die Fundoskopie ist unauffällig. Die Gesichtsfelder zeigen ein relatives zentrales Skotom. Das ERG ist das nützlichste Instrument zur Funktionsbeurteilung. Es zeigt, dass die Zapfenfunktion fehlt, während die Stäbchenfunktion normal ist. Es wurden Mutationen in mehreren Genen festgestellt, die eine Achromatopsie verursachen.
Prognose: Es gibt kein Fortschreiten der Krankheit und keine andere Behandlung als die Unterstützung des Sehvermögens. Die Gentherapie hat erste vielversprechende Ergebnisse erbracht: In Tiermodellen, die dem menschlichen Phänotyp ähneln, wurde die Wiederherstellung der Zapfenfunktion durch eine viral vermittelte Genersatztherapie mit verschiedenen Formen eines roten Zapfen-Opsin-Promotors erreicht.
X-chromosomale Retinoschisis2
Beschreibung und Vererbung - Es handelt sich um eine rezessive X-chromosomale Krankheit, die durch Mutationen des RS1-Gens verursacht wird, das für das Protein Retinoschisin kodiert. Dies führt zu einer Retinoschisis oder einer Aufspaltung der Netzhautschichten, in der Regel in der äußeren plexiformen Schicht. In dem betroffenen Teil der Netzhaut ist das Sehvermögen suboptimal.
Erscheinungsbild - es sind fast ausschließlich junge Männer betroffen. Die Prävalenz wird auf etwa 1:15.000-1:30.000 geschätzt. Periphere Retinoschisis wird bei etwa der Hälfte der Patienten beobachtet. Eine foveale Retinoschisis ist bei fast allen Patienten vorhanden und lässt sich mit SD-OCT erkennen, das zystische Räume innerhalb der Netzhaut zeigt. Das zentrale Sehen kann beeinträchtigt sein, wobei die Sehschärfe zwischen 20/30 und weniger als 20/200 liegt. Der Verlust der Sehschärfe wird durch die Bildung winziger Zysten zwischen den einzelnen Schichten der Netzhaut verursacht. Diese Zysten bilden oft ein "Speichenrad"-Muster. Das periphere Sehen kann auch verloren gehen, wenn sich die innere Schicht der Nervenzellen von der äußeren Schicht der Zellen abspaltet.
Prognose - Kürzlich wurde gezeigt, dass die topische Verabreichung der Kohlensäureanhydrasehemmer Dorzolamid und Brinzolamid die Makulazysten bei Patienten mit X-chromosomaler Retinoschisis wirksam reduziert.
Familiäre Drusen (North Carolina Makuladystrophie)9
Beschreibung - Diese Erkrankung (mit Unterformen, die als Doyne's honeycomb choroiditis oder malattia leventinese bekannt sind) gilt als eine frühe Form der altersbedingten Makuladegeneration. Sie ist gekennzeichnet durch gut abgegrenzte, cremegelbe Flecken (Drusen) auf der Makula, die sich schließlich weit über den hinteren Augenpol und um den Sehnervenkopf herum ausbreiten können.
Vererbung - autosomal-dominant mit voller Penetranz, aber unterschiedlicher Expressivität.
Präsentation - die Drusen werden in der Regel erst um das fünfte Lebensjahrzehnt herum visuell problematisch und die Patienten erleben dann eine zentrale Sehverschlechterung.
Prognose: Es handelt sich um eine fortschreitende Krankheit, aber das periphere Sehen bleibt erhalten.
Biettis kristalline Dystrophie10
Beschreibung - Diese Erkrankung ist durch kristalline Ablagerungen in der peripheren Hornhaut und der Netzhaut gekennzeichnet. Dies kann mit einer fortschreitenden Atrophie der Netzhaut einhergehen.
Vererbung - X-chromosomal oder autosomal-rezessiv.
Erscheinungsbild - im dritten Lebensjahrzehnt kommt es zu einem fortschreitenden Sehverlust, insbesondere des peripheren und des Nachtsehens.
Prognose - die Geschwindigkeit des Fortschreitens ist von Person zu Person unterschiedlich.
Progressive Zapfendystrophien11
Beschreibung: Diese Gruppe seltener Erkrankungen umfasst eine Reihe von Problemen, die von reinen Zapfenfehlfunktionen bis hin zu solchen mit mehr oder weniger stark ausgeprägten (aber in der Regel weniger schweren) Stäbchenfehlfunktionen reichen. Viele Patienten beginnen mit einem reinen Zapfenproblem, das dann im Laufe der Zeit zunehmend die Stäbchen beeinträchtigt. Die geschätzte Häufigkeit liegt zwischen 1 von 20.000 und 100.000.
Vererbung - die meisten Fälle treten sporadisch auf, aber es sind auch autosomal-dominante, autosomal-rezessive und X-chromosomale Vererbung bekannt.
Erscheinungsbild - langsamer, fortschreitender, beidseitiger Sehverlust (Nachtsehen besser als am Tag), Photophobie, schlechtes Farbensehen ± Nystagmus. Es kann auch zu Gesichtsfeldstörungen kommen.
Prognose - Kurzfristig geht es denjenigen, die weniger an den Stäben beteiligt sind, gut, aber letztlich sind die Aussichten schlecht.
Alport-Syndrom12
Das Alport-Syndrom ist eine genetisch bedingte Erkrankung, von der etwa 1 von 5.000 Kindern betroffen ist und die zu Glomerulonephritis, Nierenerkrankungen im Endstadium und Innenohrschwerhörigkeit führt. Sie kann auch die Augen betreffen.
Beschreibung: Die Erkrankung beeinträchtigt die Synthese von Kollagen Typ IV und führt zu Anomalien der Basalmembran, die sich in chronischen Nierenerkrankungen und manchmal in sensorineuraler Taubheit äußern. Verschiedene Augenanomalien werden häufig beobachtet, darunter Lenticonus (kegelförmige Linse), Keratokonus, Katarakte und Netzhautflecken in der Makula und der mittleren Peripherie. Diese bedrohen selten das Sehvermögen.
Vererbung - X-chromosomal dominant.
Präsentation - mit Nierenproblemen und, wenn auch nicht immer, mit sensorineuraler Taubheit.
Prognose - Die Sehprognose ist gut; die Sehschärfe wird normalerweise nicht beeinträchtigt. Lenticonus kann wie bei Katarakten durch den Austausch der Linse behandelt werden. Leichter Keratokonus kann mit harten Kontaktlinsen oder Huckepack-Kontaktlinsen behandelt werden; in schweren Fällen kann eine Hornhauttransplantation erforderlich sein.
Gutartige familiäre Fleckennetzhaut13 14
Bei dieser seltenen Erkrankung ist der Augenhintergrund massiv von Läsionen befallen, die als diskrete, leuchtend weiße oder gelbe Flecken erscheinen, die weit hinter den Blutgefäßen der Netzhaut liegen. Die Makula bleibt immer verschont. Fluoreszeinuntersuchungen zeigen eine gesunde Makula sowie retinale und choroidale Blutgefäße.
Beschreibung - gutartige, fovea-sparende, unregelmäßig geformte Läsionen, die die Netzhaut dicht bedecken und sich bis in die ferne Peripherie erstrecken. Sie können weiß, gelb oder grau erscheinen.
Vererbung - autosomal-rezessiv.
Präsentation - asymptomatisch, meist zufällig entdeckt.
Prognose - ausgezeichnet, das Sehvermögen ist normalerweise nicht beeinträchtigt.
Lebersche kongenitale Amaurose (LCA)15 16 17
Die LCA ist die schwerste aller Netzhautdystrophien. Die Betroffenen zeigen in der Regel im ersten Lebensjahr eine hochgradige Sehbehinderung, einen wandernden Nystagmus, eine variable Netzhautpathologie und gelegentlich andere systemische Pathologien. Es ist inzwischen bekannt, dass mindestens sechs Gene für diese Krankheit verantwortlich sind. Verschiedene Mutationen in mehreren dieser Gene wurden als Ursache für Retinitis pigmentosa und andere Netzhautdystrophien beobachtet. Es wird vermutet, dass der LCA-Phänotyp daher auf Mutationen zurückzuführen ist, die die schwerwiegendsten Folgen haben.
Die geschätzte Prävalenz liegt bei 1 : 50.000-100.000 - es handelt sich um eine früh einsetzende, vererbte Ursache für eine schwere Sehbehinderung im Kindesalter, die durch eine schwere Netzhautdystrophie gekennzeichnet ist. Sie tritt typischerweise im ersten Lebensjahr auf.
Beschreibung - Die Sehfunktion ist in der Regel schlecht und geht häufig mit Nystagmus, träger oder fehlender Pupillenreaktion, Photophobie, hoher Hyperopie und Keratokonus einher. Die Sehschärfe ist selten besser als 20/400.
Vererbung - Varianten in mindestens sechs Genen wurden mit LCA oder früh einsetzender Retinitis pigmentosa in Verbindung gebracht, was zu einer genetisch heterogenen Vererbung führt.
Präsentation - Kinder sind entweder von Geburt an oder in den ersten Lebensjahren stark sehbehindert. Ein charakteristischer Befund ist das "Franceschetti-Okulo-Digital-Zeichen", bei dem die Augen gestochen, gedrückt und gerieben werden. Ständiges Reiben der Augen führt zu einer Resorption von Orbitalfett und anschließendem Endophthalmus (in die Augenhöhlen eingesunkene Augen). Die Netzhaut kann anfangs normal erscheinen, doch wird im späteren Kindesalter häufig eine pigmentäre Retinopathie ähnlich der Retinitis pigmentosa beobachtet. Das ERG ist typischerweise nicht nachweisbar oder stark subnormal.
Prognose: Die Behandlung ist unterstützend. Die Kinder profitieren von der Korrektur des Brechungsfehlers, der Verwendung von Hilfsmitteln für geringes Sehvermögen, wenn dies möglich ist, und der Unterstützung bei Bildungsangeboten. Wenn möglich, sollten die Kinder davon abgehalten werden, wiederholt in ihren Augen zu stochern und zu drücken. Bei Kindern mit Restsehvermögen ist eine regelmäßige Untersuchung auf Amblyopie, Glaukom oder Katarakt erforderlich. Eine Gentherapie könnte in Zukunft von Nutzen sein: Versuche mit einer Genersatztherapie haben sich als erfolgreich erwiesen, wenn es darum ging, betroffenen Hunden das Augenlicht wiederzugeben.18
Angeborene stationäre Nachtblindheit16 19
Hierbei handelt es sich um eine Gruppe seltener, nicht progressiver Erkrankungen der Netzhaut, bei denen eine abnorme Stäbchenfunktion zu einer Beeinträchtigung des Nachtsehens führt. Die meisten familiären Fälle sind X-chromosomal vererbt, es wurde jedoch auch eine autosomale Dominanz beschrieben. Damit verbunden sind okuläre Symptome wie Myopie, Hyperopie, Nystagmus und verminderte Sehschärfe.
Beschreibung - Die Prävalenz dieser Erkrankung ist unbekannt, aber sehr gering. Sie ist von Geburt an vorhanden.
Vererbung - je nach Subtyp kann sie autosomal-dominant, autosomal-rezessiv oder X-chromosomal-gebunden sein.
Erscheinungsbild - schlechtes Nachtsehen als Folge einer Verzögerung oder einer Unfähigkeit, normale dunkeladaptierte Stäbchenschwellen zu erreichen. Die Patienten leiden unter Nachtblindheit, verminderter Sehschärfe, hoher Myopie, Nystagmus und Strabismus. Es gibt zwei Haupttypen - die vollständige Form und die unvollständige Form. Die vollständige Form führt immer zu Nachtblindheit, während die unvollständige Form nicht immer dazu führt. Die beiden Formen werden durch das ERG unterschieden.
Prognose: Kein Fortschreiten der Krankheit.
Kongenitaler Monochromatismus20
Beschreibung: Dies ist ein Oberbegriff, der verschiedene Grade des Stäbchen- oder Zapfenmonochromatismus beschreibt. Er kann mit Störungen der endokrinen oder hypothalamischen Funktion und mit sensorineuraler Taubheit verbunden sein.
Vererbung - je nach Subtyp, autosomal-rezessiv oder X-chromosomal.
Darstellung - Farbenblindheit: Wenn das Farbensehen völlig fehlt, wird die Welt in Grautönen gesehen. Bei unvollständigem Stäbchen-Monochromatismus kann eine gewisse Farbwahrnehmung vorhanden sein. Der Monochromatismus der Zapfen ist mit einer besseren Sehschärfe (6/6 bis 6/9) verbunden als der Monochromatismus der Stäbchen (bei vollständigem Monochromatismus liegt die Sehschärfe im Bereich von 6/60).
Prognose: Kein Fortschreiten der Krankheit.
Dr. Mary Lowth ist eine der Autorinnen oder die ursprüngliche Autorin dieses Merkblatts.
Weiterführende Literatur und Referenzen
- Königliches Nationales Institut für Blinde (RNIB)
- Lebersche kongenitale Amaurose; Kontakt zu einer Familie
- Ziccardi L, Cordeddu V, Gaddini L, et alGentherapie bei Netzhautdystrophien. Int J Mol Sci. 2019 Nov 14;20(22):5722. doi: 10.3390/ijms20225722.
- Solebo AL, Teoh L, Rahi JEpidemiologie der Erblindung bei Kindern. Arch Dis Child. 2017 Sep;102(9):853-857. doi: 10.1136/archdischild-2016-310532. Epub 2017 May 2.
- Brito-Garcia N, Del Pino-Sedeno T, Trujillo-Martin MM, et alWirksamkeit und Sicherheit von Nahrungsergänzungsmitteln bei der Behandlung hereditärer Netzhautdystrophien: eine systematische Übersicht. Eye (Lond). 2017 Feb;31(2):273-285. doi: 10.1038/eye.2016.286. Epub 2016 Dec 9.
- Kannabiran C, Mariappan ITherapeutische Möglichkeiten für erbliche Formen der Netzhautblindheit. J Genet. 2018 Mar;97(1):341-352.
- Nentwich MM, Rudolph GHereditäre Netzhauterkrankungen im Kindes- und Jugendalter, die die zentrale Netzhaut betreffen. Oman J Ophthalmol. 2013 Sep;6(Suppl 1):S18-25. doi: 10.4103/0974-620X.122290.
- Moore T, Burton HGenetische Ophthalmologie im Fokus: A Needs Assessment & Review of Specialist Services for Genetic Eye Disorders, April 2008.
- Rozet JM, Gerber S, Ducroq D, et alHereditäre Makuladystrophien. J Fr Ophtalmol. 2005 Jan;28(1):113-24.
- Thumann GPerspektiven für die Gentherapie von Netzhautdegenerationen. Curr Genomics. 2012 Aug;13(5):350-62. doi: 10.2174/138920212801619214.
- Shah M, Zaman M, Khan MT, et alVisuelle Rehabilitation von Patienten mit Morbus Stargardt. J Coll Physicians Surg Pak. 2008 May;18(5):294-8.
- Do P, Ferrucci SFoveomakuläre vitelliforme Dystrophie bei Erwachsenen. Optometrie 2006 Apr;77(4):156-66.
- Komaromy AM, Alexander JJ, Rowlan JS, et alGentherapie rettet die Zapfenfunktion bei kongenitaler Achromatopsie. Hum Mol Genet. 2010 Jul 1;19(13):2581-93. doi: 10.1093/hmg/ddq136. Epub 2010 Apr 8.
- Zhu Z, Zou H, Li C, et alDie mögliche Pathogenese der Makulakaldera bei Patienten mit North Carolina Makuladystrophie. BMC Ophthalmol. 2022 Nov 19;22(1):447. doi: 10.1186/s12886-022-02655-w.
- Vargas M, Mitchell A, Yang P, et alBietti Crystalline Dystrophie. GeneReviews®, April 2012.
- Gill JS, Georgiou M, Kalitzeos A, et alProgressive Zapfen- und Zapfenstäbchendystrophien: klinische Merkmale, Molekulargenetik und Therapieaussichten. Br J Ophthalmol. 2019 Jan 24;103(5):711-20. doi: 10.1136/bjophthalmol-2018-313278.
- Savige J, Lipska-Zietkiewicz BS, Watson E, et alLeitlinien für Gentests und die Behandlung des Alport-Syndroms. Clin J Am Soc Nephrol. 2022 Jan;17(1):143-154. doi: 10.2215/CJN.04230321. Epub 2021 Dec 20.
- Bin NJ, Heng HM, Poh R, et alPhospholipase A2 Gruppe v in benigner familiärer Fleckennetzhaut in einer Gruppe von Drillingen. Retina. 2015 Jun;35(6):1266-72. doi: 10.1097/IAE.0000000000000446.
- Sabel Aish SF, Dajani BBenigne familiäre Fleckennetzhaut. Br J Ophthalmol. 1980 Sep;64(9):652-9.
- Francis PJGenetik von erblichen Netzhauterkrankungen. J R Soc Med. 2006 Apr;99(4):189-91.
- Pusch CM, Zeitz C, Brandau O, et alDie vollständige Form der X-chromosomalen kongenitalen stationären Nachtblindheit wird durch Mutationen in einem Gen verursacht, das für ein leucinreiches Wiederholungsprotein kodiert. Nat Genet. 2000 Nov;26(3):324-7.
- Weleber RG, Francis PJ, Trzupek KM, et alKongenitale Leber-Amaurose
- Drack AV, Johnston R, Stone EMWelche Patienten mit Leber kongenitaler Amaurose kommen für Gentherapieversuche in Frage? J AAPOS. 2009 Oct;13(5):463-5.
- Abramowicz MJ, Ribai P, Cordonnier MKongenitale stationäre Nachtblindheit: Bericht über eine autosomal rezessive Familie und Kopplungsanalyse. Am J Med Genet A. 2005 Jan 1;132A(1):76-9.
- Jan JE, Tze WJ, Johnston AC, et al; Familiärer kongenitaler Monochromatismus, Katarakte und sensorineurale Taubheit. Am J Dis Child. 1976 Dec;130(12):1349-50.
Lesen Sie unten weiter
Artikel Geschichte
Die Informationen auf dieser Seite wurden von qualifizierten Klinikern verfasst und von Fachleuten geprüft.
Nächste Überprüfung fällig: 19 Juli 2028
21 Juli 2023 | Neueste Version

Fragen, teilen, verbinden.
Stöbern Sie in Diskussionen, stellen Sie Fragen, und tauschen Sie Erfahrungen zu Hunderten von Gesundheitsthemen aus.

Fühlen Sie sich unwohl?
Beurteilen Sie Ihre Symptome online und kostenlos